
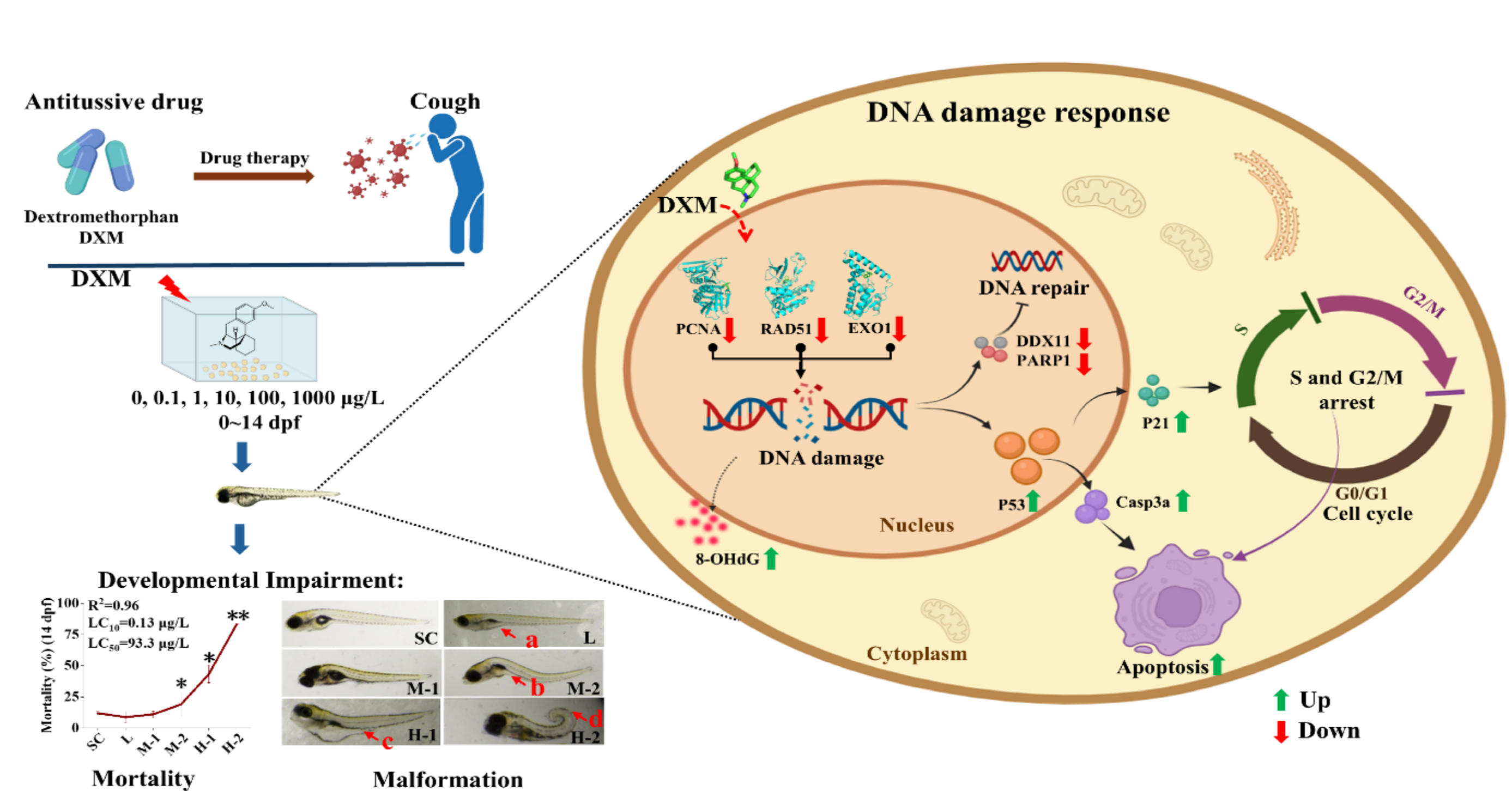
最近,华南师范大学环境学院应光国教授团队的马栋栋博士、史文俊副研究员等人在《Journal of Hazardous Materials》期刊上发表了题为“Antitussive drug dextromethorphan induces developmental impairment in zebrafish”的研究论文(DOI: 10.1016/j.jhazmat.2024.137042)。这项研究发现镇咳药右美沙芬(DXM)暴露诱导斑马鱼幼鱼DNA损伤,并伴随着DNA修复失败、细胞周期停滞和细胞凋亡,最终导致幼鱼显著的畸形和死亡。这一发现揭示了DXM诱导斑马鱼发育毒性的主要机制是DNA损伤,强调了DXM对生态和人类健康的潜在风险。
图文摘要
全文速览
右美沙芬(DXM)是止咳和感冒药中的常见成分。尽管它在水生环境中广泛存在,但DXM对水生生物的影响仍然未知。本研究评估了环境浓度DXM(0.06、0.61、8.12、76.3和827 μg/L)暴露斑马鱼胚胎至14天(dpf)对斑马鱼的发育的影响。结果表明,DXM暴露至14 dpf时,LC50为93.3 μg/L,表明DXM对斑马鱼具有高毒性。此外,在72 hpf、7 dpf和14 dpf,DXM显著降低幼鱼的体长和心率,增加畸形。生物化学分析和转录组学分析表明,在7 dpf和14 dpf时,DXM暴露诱导幼鱼DNA损伤,并引发DNA损伤反应(如DNA修复失败、细胞周期停滞和细胞凋亡)。这些结果帮忙解释了DXM通过DNA损伤途径诱导斑马鱼幼鱼严重的发育损伤,强调了环境中DXM在生态和公共卫生风险中重要性。
引言
右美沙芬(DXM)是一种广泛使用的非处方药物,用于治疗咳嗽。因其有效的止咳作用、已经使用了50多年。近年来,DXM被频繁用于治疗2019冠状病毒病(COVID-19)。DXM也被作为精神类药物大量使用甚至滥用。然而,由于DXM使用后在人体内不完全代谢,导致DXM在城市污水、地表水和沉积物中广泛检出。有研究表明,高浓度的DXM可以诱导大鼠和人的行为效应和神经毒性。有限的研究表明,暴露于高浓度DXM(543 mg/L)诱导斑马鱼幼鱼发育毒性。这些结果表明,DXM对鱼类具有潜在发育毒性。然而,环境相关浓度DXM对水生生物的研究相对较少。需要进一步的探究环境相关浓度DXM诱导鱼类发育毒性的分子机制。在生命早期细胞周期短,DNA复制快,胚胎对DNA损伤特别敏感。因此,生命早期阶段的DNA损伤对鱼类胚胎发育有不利影响。在本研究中,斑马鱼胚胎在受精后2 hpf至14 dpf暴露于DXM,并评估环境相关浓度DXM诱导鱼类发育毒性的分子机制。
图文导读
1、DXM暴露诱导斑马鱼幼鱼发育损伤
在7 dpf和14 dpf,DXM暴露诱导死亡率呈剂量依赖性增加。在最高浓度处理组(H-1),暴露至14 dpf死亡率增加到80%以上(图1A)。14 dpf时,10%致死浓度(LC10)和50%致死浓度(LC50)分别为0.13和93.3 μg/L。在M-2、H-1和H-2处理组,DXM降低72 hpf幼鱼心率,相应的50%抑制浓度(IC50)为1950 μg/L(图1B)。此外,在7 dpf和14 dpf,随着DXN剂量的增加,幼鱼体长呈线性减少,对应的IC50值分别为1550和3000 μg/L(图1C,D)。斑马鱼发育早期形态学检查发现多种畸形,比如:鱼鳔缺失、颅面异常、腹水、尾端上翘、脊柱弯曲和严重畸形(图1E)。在H-2处理组,DXM增加72 hpf畸形(图1F)。7 dpf和14 dpf时,DXM诱导幼鱼畸形随剂量增加而增加(图1G,H)。对照组在整个实验期间未见畸形(图1F,H)。这些结果表明,DXM暴露诱导斑马鱼幼鱼严重的发育损伤。
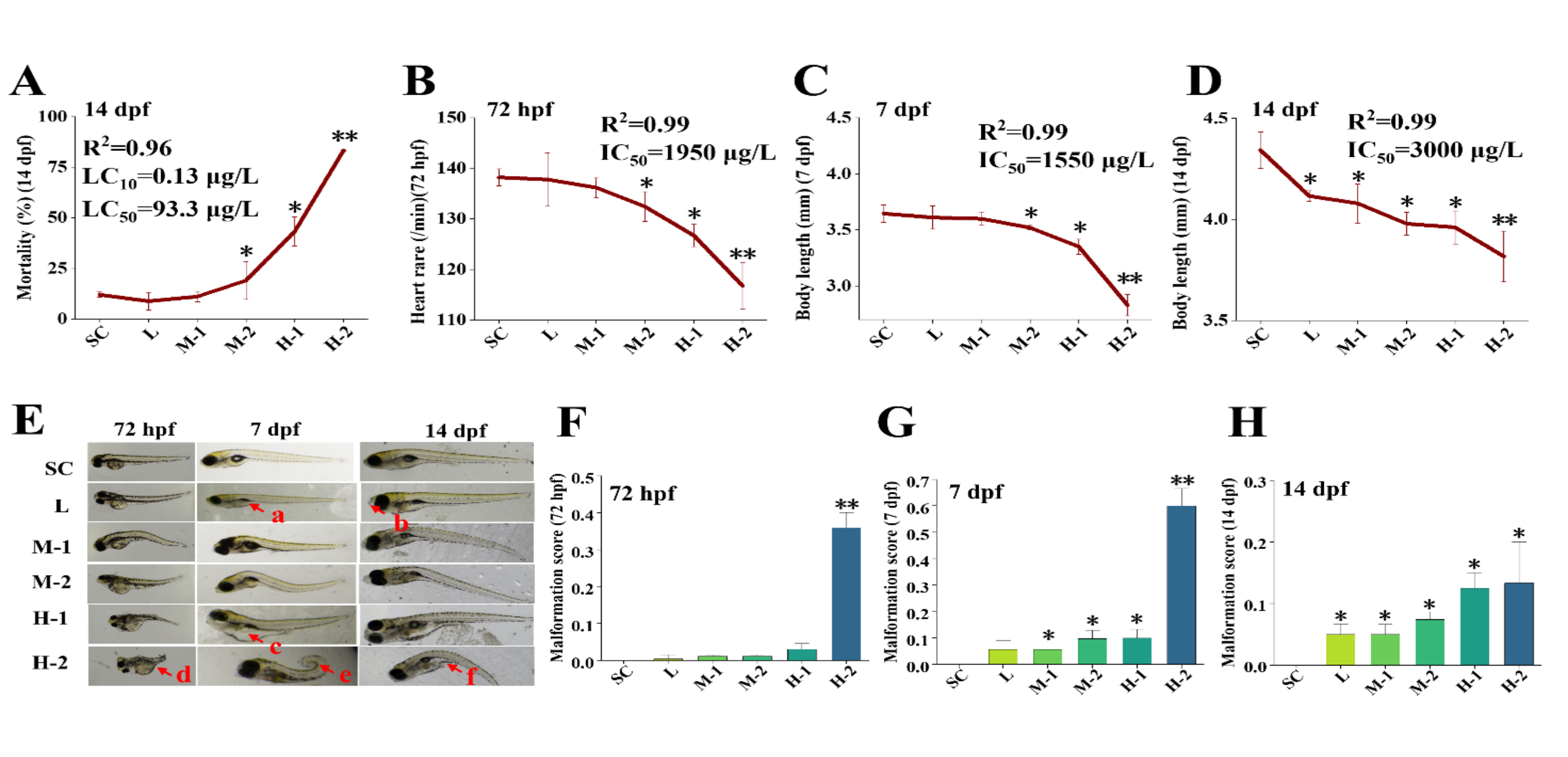
Fig. 1. Developmental impairment was induced by DXM in zebrafish larvae.
图1. DXM暴露诱导斑马鱼幼鱼发育损伤。
2、DXM暴露导致斑马鱼幼鱼DNA损伤
7 dpf和14 dpf时,DXM处理组和对照组在生化指纹区(1800-900 cm−1)和核酸区(1480-1030 cm−1)(图2A-C,E-G)分离。在7 dpf和14 dpf时,A-DNA/B-DNA比值呈浓度依赖性增加趋势(图2D,H)。值得注意的是,M-2和H-1组在14 dpf时,Z-DNA/B-DNA比值显著升高(图2H),而在7 dpf时,DXM降低了所有组的Z-DNA/B-DNA比值(图2D)。这些结果表明DXM暴露导致斑马鱼幼鱼DNA结构发生改变,可能导致DNA损伤。
DNA梯形电泳图谱证实了DXM对斑马鱼幼鱼DNA的损伤作用。在7 dpf和14 dpf时,琼脂糖凝胶电泳显示DXM暴露导致梯形DNA电泳图的形成(图2I,J)。为了进一步量化DNA损伤程度,我们测定了幼鱼体内8-OHdG的水平。在7 dpf时,DXM增加了M-1处理组8-OHdG水平(图2K)。14 dpf时,8-OHdG含量在M-1、M-2和H-1处理组显著升高(图2L)。结果表明,DXM暴露导致斑马鱼幼鱼DNA损伤,这可能是DXM诱导幼鱼发育损伤的重要原因。
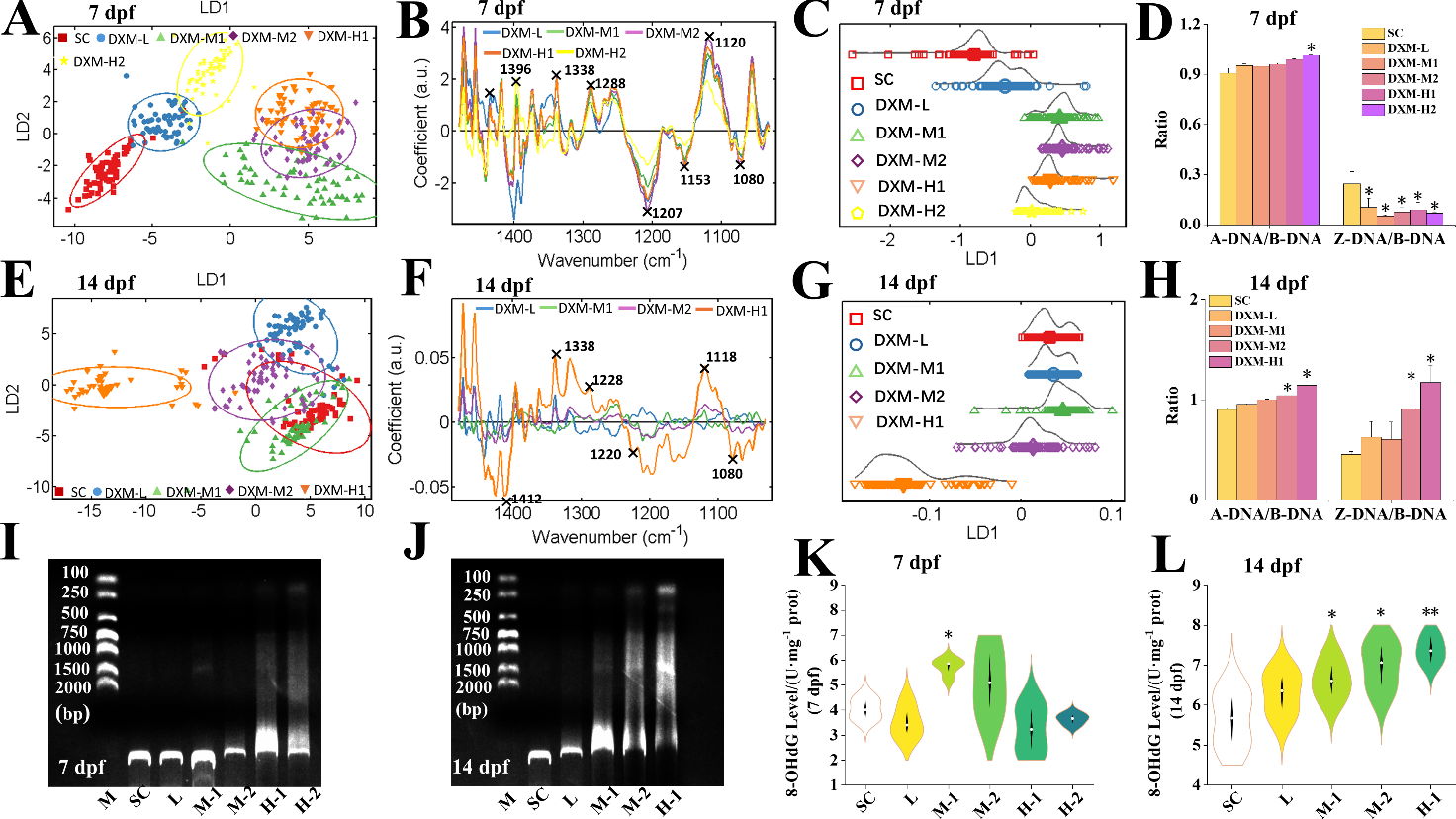
Fig. 2. Effect of DXM on DNA damage in zebrafish larvae.
图2. DXM暴露诱导斑马鱼幼鱼DNA损伤。
3、转录组分析解释发育毒性机制
由于在14 dpf时幼鱼死亡率较高(> 80%)。因此,为了探索DXM暴露对幼鱼发育毒性的分子机制,我们对H-1处理组幼鱼进行了转录组分析。结果表明,共有2770个差异表达基因被富集(Fold Change > 2,p < 0.05),其中335个上调基因,2435个下调基因(图3A)。16个差异基因的qPCR结果与转录组分析结果一致,表明转录组结果的准确性(图3C)。
根据GO分析结果,筛序出显著性前10的生物过程、细胞成分和分子功能(图3B)。显著富集的生物过程主要包括DNA修复、DNA复制、细胞对DNA损伤刺激的反应和双链断裂修复(图3D)。根据富集显著性,前10的KEGG通路包括DNA复制、核苷酸切除修复(NER)、碱基切除修复(BER)、同源重组(HR)、错配修复(MMR)和细胞周期(图3E)。
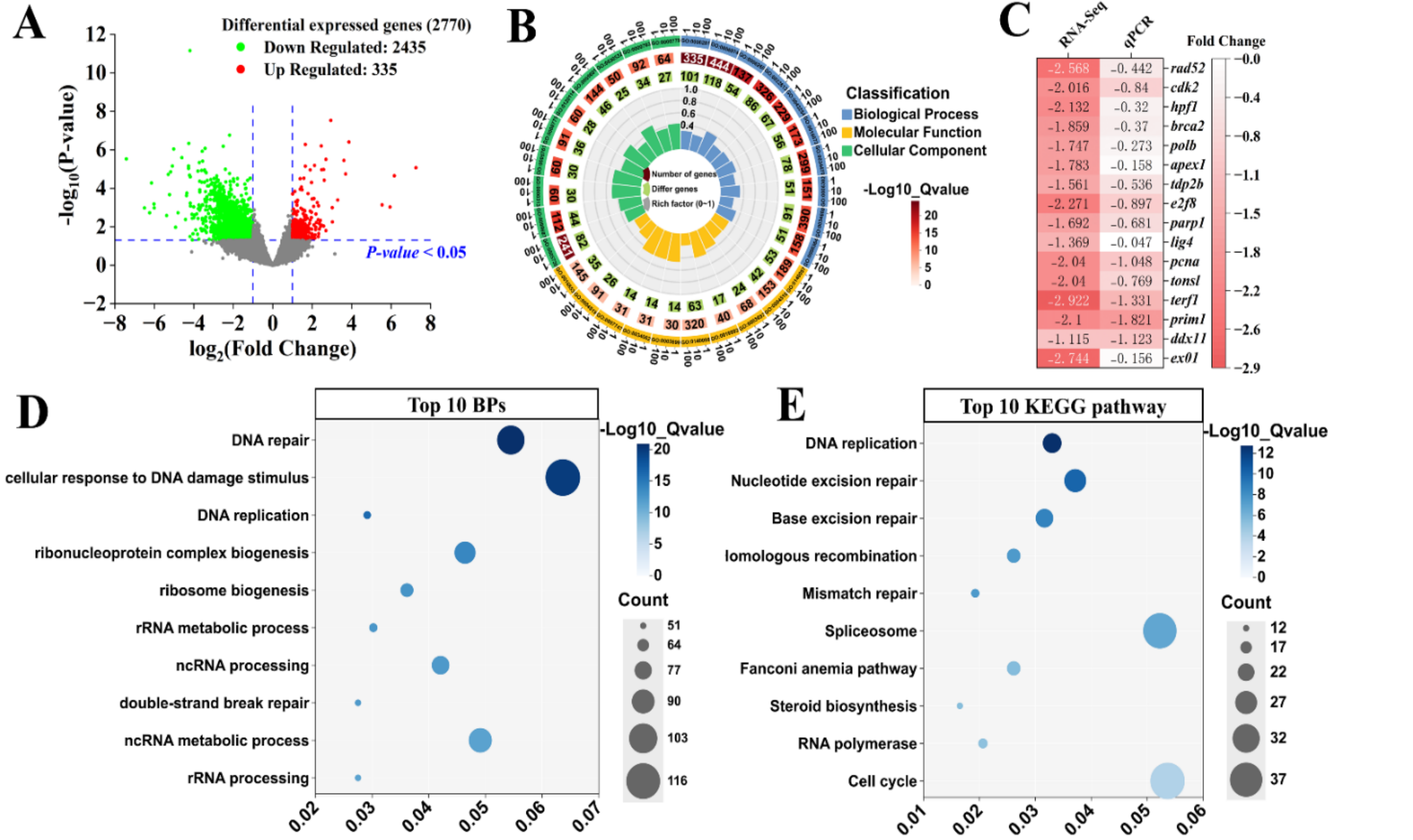
Fig. 3. Transcriptomic analysis of larvae exposed to DXM.
图3. 斑马鱼幼鱼转录组分析。
4、蛋白互作网络和分子对接分析毒性机制
转录组结果中与DNA损伤反应相关的所有差异基因进行网络分析。其中,PCNA、RAD51和EXO1蛋白质聚集在了相互作用网络的中心(图4A)。为了证明DXM与PCNA、RAD51和EXO1的相互作用关系,我们把DXM与三个蛋白进行分子对接。结果表明,DXM与PCNA中的氨基酸ASP58A形成一个稳定的氢键(图4B),DXM与RAD51中的氨基酸ASN110A形成一个稳定的氢键(图4C),DXM与EXO1中的氨基酸ASN124A形成一个稳定的氢键(图4D)。DXM与PCNA、RAD51和EXO1形成的最低捆绑能量分别为−5.3、−6.0和−6.0 kcal/mol。
在7 dpf时,DXM降低了M-2和H-1处理组中pcna的转录表达,以及M-2、H-1和H-2处理组中的rad51和exo1的转录表达(图4E)。在14 dpf时,DXM降低了M-2和H-1处理组中的rad51和pcna的转录表达,以及所有处理中的exo1的转录表达(图4F)。PCNA、RAD51和EXO1在DNA复制和损伤修复过程中发挥重要作用。因此,这些结果表明,DXM通过干扰DNA复制和损伤修复诱导DNA损伤。
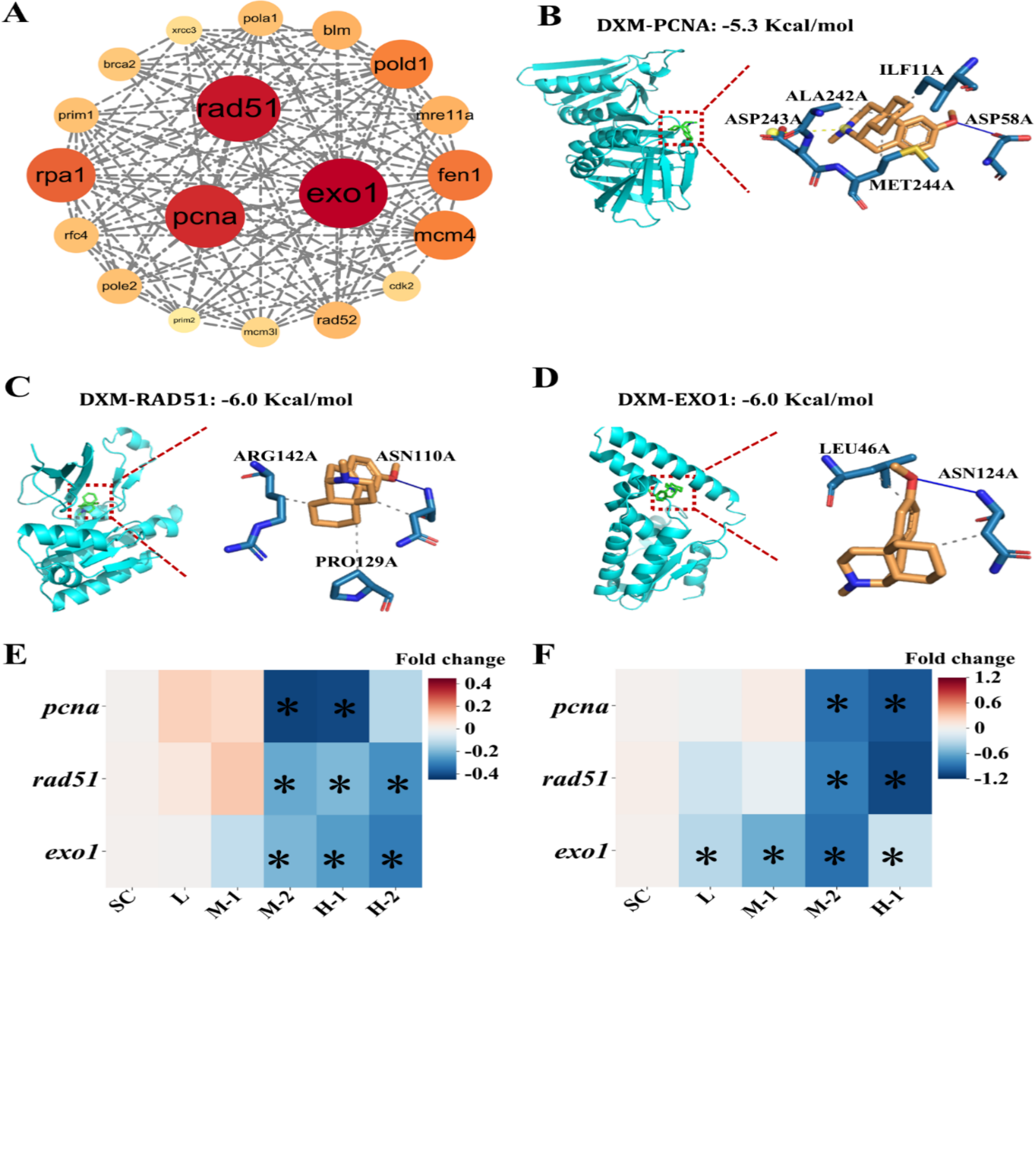
Fig. 4. Molecular docking and transcriptional alterations of genes in the core network of DNA damage response
图4. DNA损伤反应核心网络中关键基因的分子对接和转录改变。
5、细胞循环和细胞凋亡分析
RNA-Seq分析显示,DXM暴露14 dpf时导致细胞周期发生显著变化。G1(第一个间隙)、S(DNA复制)、G2(第二个间隙)和M(有丝分裂)期的异常表明7 dpf和14 dpf幼鱼细胞周期受到干扰(图5A-D)。在7 dpf时,DXM增大M-2、H-1和H-2处理组幼鱼S期和G2/M期细胞的百分比(图5E)。在14 dpf,DXM增加H-1处理组幼鱼S期和G2/M期细胞的百分比(图5F)。为了进一步了解毒性机制,用qPCR检测了与细胞周期相关基因的表达。根据RNA-Seq结果,选择所有与细胞周期相关的差异基因。使用STRING构建差异基因相互作用蛋白网络,其中评分最高的8个差异基因聚集到了网络的中心(图5G)。qPCR结果显示,在7 dpf时,DXM降低了H-1和H-2处理组中ccne1、cdk2、orc4、orc6、mcm4和mcm3基因的转录表达,并增加了cdkn1a的转录表达(图5H)。在14 dpf时,DXM降低了所有处理组中的ccne1的转录表达,提高了cdkn1a的转录表达(图5H)。DXM同时降低了14 dpf幼鱼mcm4、mcm3、cdk2、orc4、orc6和cdc20的转录表达(图5H)。
DXM暴露7 dpf后诱导幼鱼细胞凋亡增加(图5I,J)。在7 dpf时,DXM增大了M-2、H-1和H-2处理组幼虫的荧光强度(图5K)。此外,在H-2处理中,DXM增加了H-2处理p53的转录表达,以及H-1和H-2处理中casp3a、noxa和bcl2的转录表达(图5L)。在14 dpf时,DXM上调了所有处理组中p53的转录表达,M-2和H-1处理组中casp3a的转录表达(图5L),增加了L、M-1和M-2处理组中noxa的转录表达,以及M-1、M-2和H-1处理组中bax的转录表达(图5L)。这些结果表明,DXM暴露导致幼鱼细胞周期停滞和细胞凋亡。细胞周期停滞和细胞凋亡是主要的DNA损伤反应。因此,本研究结果进一步证明DXM通过DNA损伤途径诱导斑马鱼幼鱼发育损伤,
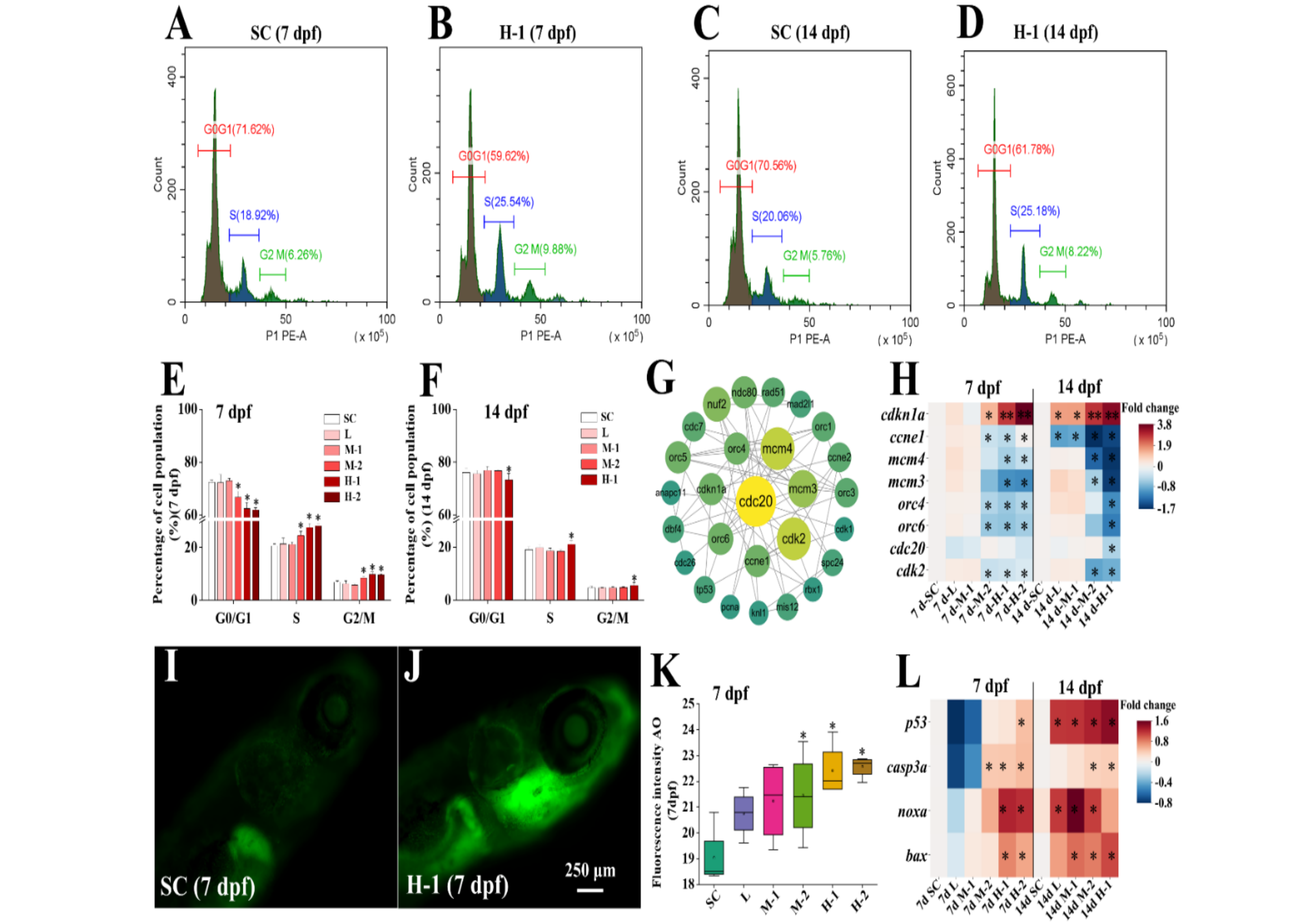
Fig. 5. Effect of DXM exposure on the cell cycle and apoptosis in zebrafish larvae.
图5. DXM暴露对斑马鱼幼鱼细胞周期和细胞凋亡的影响。
结论与意义
本研究探究了环境相关浓度DXM对斑马鱼幼鱼的发育毒性。结果表明,DXM暴露能导致幼鱼发育损伤,包括死亡率和畸形率升高,体长和心率降低。同时,DXM诱导幼鱼DNA损伤,并伴随DNA损伤反应(DNA修复失败、细胞周期停滞和细胞凋亡),最终导致斑马鱼幼鱼显著的发育损伤。这些发现表明,DXM通过DNA损伤反应通路诱导斑马鱼幼鱼发育损伤。该研究为DXM对鱼类的发育毒性提供了有价值的见解,并强调了评估DXM对水生生态系统潜在风险的重要性。
论文链接
Ma, D. D., Shi, W. J., Lu, Z. J., Zhang, J. G., Hu, L. X., Huang, Z., Li, S. Y., Long, X. B., Liu, X., Huang, C. S., Ying, G. G. Antitussive drug dextromethorphan induces developmental impairment in zebrafish. Journal of hazardous materials 2024, 486, 137042. https://url.scnu.edu.cn/record/view/index.html?key=6c1af603309771d862bafaf58c2a291d.
Ma, D. D., Shi, W. J., Li, S. Y., Zhang, J. G., Lu, Z. J., Long, X. B., Liu, X., Huang, C. S., Ying, G. G. Ephedrine and cocaine cause developmental neurotoxicity and abnormal behavior in zebrafish. Aquatic toxicology 2023, 265, 106765. https://doi.org/10.1016/j.aquatox.2023.106765